典型化学平衡图像专题
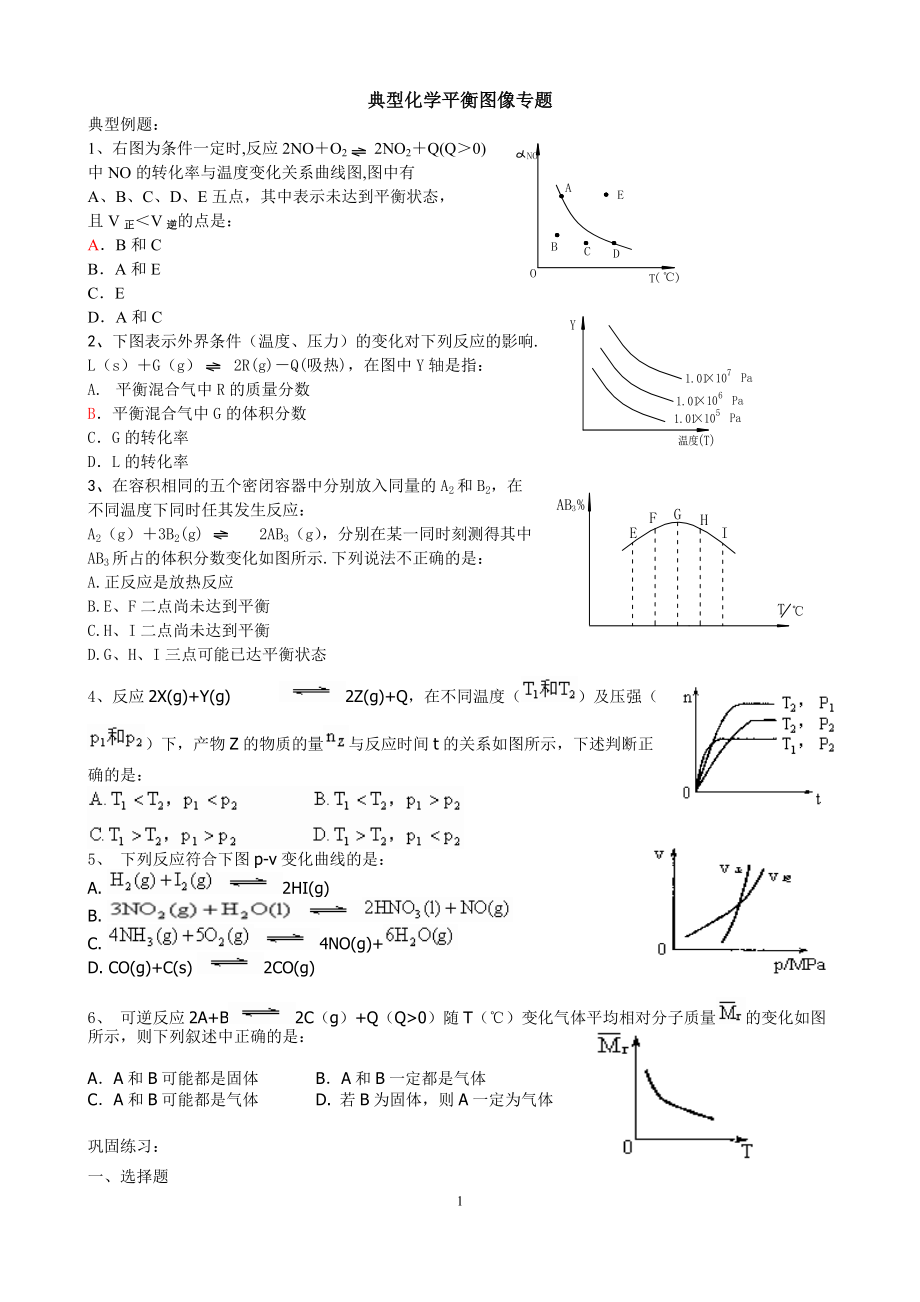
典型化学平衡图像专题典型例题:1、右图为条件一定时,反应2NO+O2 2NO2+Q(Q>0)中NO的转化率与温度变化关系曲线图,图中有A、B、C、D、E五点,其中表示未达到平衡状态,且V正<V逆的点是:A.B和C B.A和EC.E D.A和C 2、下图表示外界条件(温度、压力)的变化对下列反应的影响.L(s)+G(g) 2R(g)-Q(吸热),在图中Y轴是指:A. 平衡混合气中R的质量分数B.平衡混合气中G的体积分数C.G的转化率D.L的转化率3、在容积相同的五个密闭容器中分别放入同量的A2和B2,在不同温度下同时任其发生反应:A2(g)+3B2(g) 2AB3(g),分别在某一同时刻测得其中AB3所占的体积分数变化如图所示.下列说法不正确的是:A.正反应是放热反应B.E、F二点尚未达到平衡C.H、I二点尚未达到平衡D.G、H、I三点可能已达平衡状态4、反应2X(g)+Y(g) 2Z(g)+Q,在不同温度()及压强()下,产物Z的物质的量与反应时间t的关系如图所示,下述判断正确的是: 5、 下列反应符合下图p-v变化曲线的是:A. 2HI(g)B. C. 4NO(g)+ D. CO(g)+C(s) 2CO(g) 6、 可逆反应2A+B2C(g)+Q(Q>0)随T(℃)变化气体平均相对分子质量的变化如图所示,则下列叙述中正确的是:A.A和B可能都是固体 B.A和B一定都是气体 C.A和B可能都是气体 D. 若B为固体,则A一定为气体 巩固练习:一、选择题1、如右图所示表示平衡混合物中x的百分含量在不同的压强下,随温度变化的情况,在下列平衡体系中,x可以代表用下横线标明的物质(反应中各物质为气态)的是:A.N2+2H2 2NH3△H<0B.H2+I2 2HI+△H<0C.2SO3 2SO2+O2△H>0D. 4NH3+5O2 4NO+6H2O△H<02、在溶积固定的4L密闭容顺中,进行可逆反应:X(气)+2Y(气) 2Z(气)并达到平衡,在此过程中,以Y的浓度改变表示的反应速率υ(正)、υ(逆)与时间t的关系如右图,如图中阴影部分面积表示:A.X的浓度的减少 B.Y的物质的量的减少C.Z的浓度的增加 D.X的物质的量的减少3.今有反应X(g)+Y(g) 2Z(g)+ △H<0若反应开始经t1秒后达到平衡,又经t2秒后,由于反应条件的改变使平衡破坏,则t3时又达到平衡,如图表示,试分析,以t2到t3秒曲线变化的原因因是:A.增大了X和Y的浓度B.使用了催化剂C.增加了反就体系的压强D.升高了反应的温度4.可逆反应N2O5 N2O4+O2△H<0在t1时达到平衡,然后在t2时开始加热,至一定温度后停止加热并增温,到t3时又建立平衡,下列各图解表示上述情况的是:A B C D5.可逆反应aX(气)+bY(气) cZ(气)+dW(气) △H=Q在压强P1、P2温度T1、T2下,产物W 的质量与反应时间t的关系如图。
下列各项正确的是:A.P1>P2B.Q<0C.T1>T2D.c+d>a+b6.都符合两个图象的反应是(C%表示反应物质量分数,v表示速率,P表示压强,t表示时间):A.N2O3(g) NO2(g)+NO(g) △H<0B.2NO2(g)+H2O(1) 2HNO3(1)+NO(g)+ △H<0C.4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H<0D.CO2(g)+C(s) 2CO(g) △H>0(1) (2)7.对于反应A(气)+2B(气) 2C(气) △H<0,下面各图能正确反映在这一反应中,反应时间t,温度T与平衡混合物中C的百分含量关系的是:A B C D8.在密闭容器中发生反应2SO2+O2 2SO2(气),起始时SO2和O2分别为20mol和10mol,达到平衡时,SO2的转化率为80%,若从SO3开始进行反应,在相同的条件下,欲使平衡时各成分的体积分数与前者相同,则起始时SO3的物质的量及SO3的转化率分别为:A.10mol和10% B.20mol和20% C.20mol和40% D.30mol和80%9.右图中,a曲线表示一定条件下可逆反应X(g)+Y(g) 2Z(g)+W(s)+Q的反应过程,若使a曲线变为b曲线,可采取的措施是:A.降低温度 B.增大Y的浓度C.加入催化剂 D.增大体系压强10.在密闭容器中发生反应:aX(气)+bY(气) cZ(气)+dW(气),反应达到平衡后,保持温度不变,将气体压缩到原来的体积,当再次达到平衡时,W的浓度为原平衡的1.8倍,下列叙述中不正确的是:A.平衡向逆反应方向移动 B.a+b<c+dC.Z的体积分数增加 D.X的转化率下降11.对于可逆反应:A2(g)+3B2(g) 2AB3(g)+Q(Q>0),下列图像中正确的是:12.在等温、等容条件下有下列气体反应:2A(g)+2B(g) C(g)+3D(g)。
现分别从两条途径建立平衡:Ⅰ.A和B的起始浓度均为2mol·L—1;Ⅱ.C和D的起始浓度分别为2mol·L—1和6mol·L—1.下列叙述正确的是:A.Ⅰ和Ⅱ两途径最终达到平衡时,体系内混合气体的体积分数相同B.Ⅰ和Ⅱ两途径最终达到平衡时,Ⅰ中A的转化率与Ⅱ中B的产率之和不为1C.达到平衡时,Ⅰ途径的反应速率υ(A)等于Ⅱ途径的反应速率υ(A)D.达平衡时,第Ⅰ条途径混合气体的密度为第Ⅱ条途径混合气体密度的1/2二、填空题13、在一固定容积的密闭容器中,1molHI气体建立如下平衡2HI H2(g)+I2(g),此时HI的转化率为25%,其它条件不变时再充入1molHI的气体,重新平衡后HI的转化率为 25%(填“>”“<”或“=”=)14、对于吸热反应A(g)+B(g) C(g)+D(g) A的转化率与压强(P)和温度(T)的关系如图所示则T1、T2、T3的关系是___________.15、在一定条件下,可逆反应A+B mC的变化如右图所示,已知坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2的温度时达到平衡后向容器加压的变化情况,问:⑴温度T1_________T2(填<、>或=)⑵正反应是_______反应(填吸热或和热).⑶如果A、B、C均为气体,则m_______2(填<、>或=)⑷当温度和容积不变时,如在平衡体系中加入一定量的某稀有气体,则体生活费的压强_________,平衡______移动.16、可逆反应2A(g)+B(g) nC(g)△H=Q,图甲为同温度不同压强时,混合气体中A的体积分数A%随反应时间变化的曲线;图乙为同一压强不同温度时,混合气体中A的体积分数A%随反应时间变化的曲线试根据曲线确定 甲 乙⑴P1与P2关系___________,n______3(填<、>或=)⑵T1与T2的关系是____________,Q______0(填<、>或=)容器代号ABCD平衡时混合物平均式量1617平衡时N2的转化率20%平衡时H2的转化率30%17、把N2和H2按1:1(物质的量之比)混合均匀后分成四等份,分别充入A、B、C、D四个装有铁触媒的真空密闭容器中(容积不变),在保持相同温度的条件下,四个容器相继达到化学平衡状态,分析下表数据,回答下列问题:⑴平衡时,______________容器中NH3所占的比例最大。
⑵达到平衡时反应速率最小的容器是___________⑶四个容器的压强自小到大的排列次序是______________18、某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为见反应物A的浓度(mol/L)B随反应时间(min)的变化情况如下表:实验序号 时浓度 间温度01020304050601800℃1.00.800.670.570.500.500.502800℃C20.600.500.500.500.500.503800℃C30.920.750.630.600.600.604820℃1.00.400.250.200.200.200.20根据上述数据,完成下列填空:⑴在实验1,反应在10至20分钟时间内平衡速率为_________mol(L·min).⑵在实验2,A的初始浓度C2=________mo/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是_________________⑶设实验3的反应速率为V3,实验1的反应速率为V1,则V3________V1(填>、=、<),且C3_________1.0mol/L(填>、=、<)⑷比较实验4和实验1,可推测该反应是__________反应(选填吸热、放热)理由是___________________ 。
三、计算题19、将N2和H2按一定比例混合,在相同状况下其密度是H2的3.6倍,取0.5mol该混合气体通入密闭容器内,使之发生反应,并在一定条件下达到平衡,已知反应达到平衡后容器内压强是相同条件下反应前压强的0.76倍试求:⑴反应前混合气体的N2和H2的体积比;⑵达平衡时混合气体中氨的物质的量;⑶平衡时N2的转化率参考答案(一)1.D 2.C 3.D 4.CD 5.B 6.B 7.B 8.B 9.CD10.C 11.AC 12.AD(二)13.= 14.T1>T2>T315.(1)> (2)放热 (3)> (4)增大,不,16.(1)P1<P2,= (2)T1<T2, >17.(1)A (2)C (3)C




